F Rubba, D Borzacchiello, R Egidio, A Arenella, A Capasso, S Maiello, A Borrelli, S Avilia, C Andretta, G Battipaglia
1. Introduzione
La Medicina basata sulle evidenze (EBM ) va collocata nel processo clinico e assistenziale in modo appropriato, accogliendo anche modelli cosiddetti a razionalità limitata per quelle situazioni dove esistono rumore o bias cognitivi (1,2); la metodologia si è arricchita della conoscenza partecipata e degli indicatori incentrati sulla persona assistita (PROMPT), focalizzati sulla percezione e sul particolare sguardo sul mondo.
Questa dimensione può contribuire a supportare il sistema qualità nell’accreditamento di percorsi complessi come i programmi trapianto e quelle istituzioni del sistema sanitario, che abbiano anche una missione accademico-scientifica definiti anche quali training center.
Lo scopo di lavorare sulla qualità è scoprire nuovi e migliori trattamenti, mettere a disposizione cure complete e migliorare la qualità di vita dei pazienti attraverso una medicina fondata su prove scientifiche, con un approccio interdisciplinare (3-5). In questa configurazione il Programma trapianto CSE nelle sue tre unità (Unità clinica, Laboratorio e Aferesi) assume i connotati di un Comprehensive Cancer Centre (CCC) .
2. Dal Safety walk around all’EBM walk around
L’EBM walk around (EBMWA) modifica la tradizionale tecnica di valutazione del rischio, che prevede visite ed interviste strutturate sui temi della sicurezza e sulle cause che possono determinare eventi avversi o situazioni di criticità, aggiungendo la dimensione delle prove di efficacia e di impatto clinico e percezione sul percorso (6).
Le criticità evidenziate durante L’EBMWA si inseriscono in un database che può configurarsi in un cruscotto direzionale digitale, classificate sulla base dei fattori causali e contribuenti, ovviamente utilizzando i Livelli di evidenza degli studi (1-3).
3. Applicazioni nel sistema Qualità
Dovrebbe essere in definitiva disponibile per l’attuazione dell’EBMWA un Kit di lavoro contenente le indicazioni da seguire per la sperimentazione e l’introduzione del metodo insieme ai relativi indicatori di esito e di processo, tale strumento, eventualmente tradotto in una piattaforma digitale.
Di seguito si presenta l’introduzione sperimentale dell’EBM WA nell’ambito del Programma Trapianti di midollo osseo e CAR-T Unit dell’AOU Federico II, dove il Laboratorio di Manipolazione e Criopreservazione cellule staminali emopoietiche e Terapia cellulare effettua procedure di caratterizzazione immunofenotipica, manipolazione, criopreservazione di cellule staminali emopoietiche (CSE) ad uso trapiantologico e controlli di qualità.
Ciascuna procedura di mobilizzazione e criopreservazione è sottoposta a misurazione dei parametri di controllo preventivamente stabiliti in base alla propria esperienza ed la successiva analisi dei dati consente di ridurre il potenziale impatto negativo sull’ outcome del trapianto.
Tra i fattori che condizionano l’attecchimento del trapianto rientrano il numero e la vitalità delle cellule staminali ematopoietiche (CSE) reinfuse questo perché il processo di congelamento come è noto causa la morte di una frazione di cellule, tra cui anche le cellule CD34+,CD45+.
I controlli di qualità delle cellule staminali emopoietiche prelevate da sangue periferico (aferesi) e criopreservate consistono nell’esecuzione di test specifici allo scopo di dimostrare le caratteristiche funzionali delle CSE in termini di sicurezza ed efficacia. Per una corretta valutazione qualitativa del processo di raccolta, manipolazione, criopreservazione sono presi in esame i seguenti indicatori:
- Vitalità CD45+;
- Vitalità CD34+;
- Contaminazione Polimorfonucleati (PMN)
Le cellule staminali emopoietiche si caratterizzano per l’espressione dell’antigene di superficie CD34+ mentre le cellule nucleate totali (WBC) si caratterizzano per l’espressione dell’antigene pan-leucocitario CD45+.
Gli studi di vitalità cellulare sono effettuati mediante l’utilizzo di un colorante per gli acidi nucleici (7‐AAD- 7-amino actinomicina) che penetra nelle cellule morte mentre gli studi di valutazione quantitativa sono effettuati mediante l’utilizzo di anticorpi monoclonali diretti contro l’antigene pan-leucocitario CD45+ e contro l’antigene CD34+.
La tecnica utilizzata è la citometria a flusso (7-9), protocollo con gate logico ISHAGE (International Society of Hematotherapy and Graft Engineering).
Lo Studio delle cellule staminali /progenitrici CD34+ dopo criopreservazione viene effettuato su campione rappresentativo (segmenti satelliti) dell’unità post-scongelo in pazienti affetti da varie patologie oncoematologiche da sottoporre a trapianto di cellule staminali con l’obbiettivo di ottimizzare la valutazione quali-quantitativa delle cellule staminali CD34+ presenti nei prodotti cellulari aferetici dopo scongelamento. Questa analisi è stata condotta su un totale di 21 pazienti trapiantati nell’anno 2024 per i quali era disponibile il dato sulla vitalità delle cellule CD34+,vitalità CD45+, polimorfonucleati (PMN) specifico per ogni segmento satellite rappresentativo di ogni singola sacca reinfusa. Si riportano i risultati della valutazione dinamica della vitalità delle cellule staminali emopoietiche criopreservate e la loro correlazione con la contaminazione da polimorfonucleati (PMN).
Nella tabella 1 è riportata la vitalità media delle cellule staminali emopoietiche rilevata nei campioni rappresentativi delle unità post-scongelo, la vitalità media dei globuli bianchi (WBC) e la contaminazione da parte della popolazione dei polimorfonucleati (PMN) di 19 pazienti sottoposti a trapianto di cellule staminali. Inoltre, è riportata l’analisi statistica (si sceglie la media aritmetica per la descrizione del fenomeno/processo) ed i valori/standard di riferimento dei parametri ottimali attesi.
tabella 1
| Vitalità CD34+ Media (%) | Vitalità CD45+ Media (%) | Polimorfonucleati (PMN) Media (%) |
| 82.3% | 52.1% | 37.2% |
Valore/standard di riferimento:
| Vitalità CD34+ (%) | Vitalità CD45+ (%) | Polimorfonucleati (PMN) (%) |
| ≥70% | ≥50% | ≤50% |
In 2 dei 21 pazienti sottoposti a trapianto di cellule staminali si osserva una vitalità media delle cellule staminali emopoietiche inferiore ai valori standard di riferimento ed una crescente contaminazione di polimorfonucleati (PMN). Nella tabella 2 e’ riportata la vitalità media delle cellule staminali emopoietiche rilevata nei campioni rappresentativi delle unità post-scongelo, la vitalità media dei globuli bianchi (WBC) e la contaminazione da parte della popolazione dei polimorfonucleati (PMN).
tabella 2
| Vitalità CD34+ Media (%) | Vitalità CD45+ Media (%) | Polimorfonucleati (PMN) Media (%) |
| 27.0% | 24.5% | 73.5% |
Valore/standard di riferimento:
| Vitalità CD34+ (%) | Vitalità CD45+ (%) | Polimorfonucleati (PMN) (%) |
| ≥70% | ≥50% | ≤50% |
I dati osservati sono compatibili con una correlazione tra le due variabili discusse, che si può caratterizzare numericamente con una modello lineare generalizzato, in dimensione prospettica.
4. Conclusione
I risultati dei saggi di vitalità cellulare delle cellule staminali emopoietiche CD34+ in relazione alla variabile “contaminazione di polimorfo nucleati” evidenziano il segnale che una crescente contaminazione da parte della popolazione dei polimorfonucleati (PMN) influisce negativamente sulla vitalità delle cellule CD34+ post-scongelo. Pertanto, dall’analisi dei dati emerge che oltre al congelamento ci sono altre numerose variabili che in un processo delicato e complesso come la mobilizzazione, raccolta, manipolazione, criopreservazione possono influire negativamente sulla vitalità delle cellule CD34+. L’EBM WA ha permesso di rivelare una ulteriore variabile di impatto sull’indicatore, che va poi dimensionata attraverso la verifica prospettica.

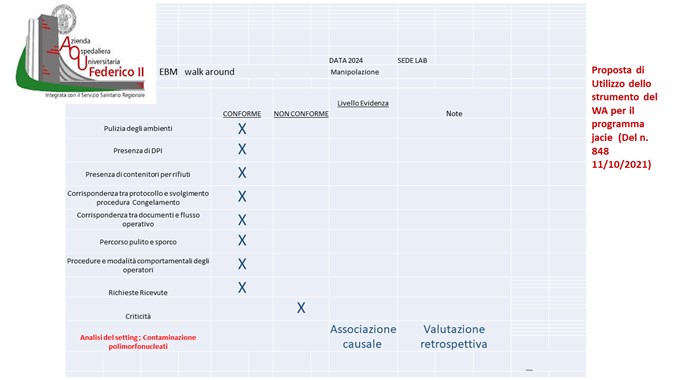
FIG 1 Scheda di WA

Bibliografia
- Sackett DL, Rosenberg WM, Gray JA, Haynes RB, Richardson WS Evidence based medicine: what it is and what it isn’t. BMJ. 1996 Jan 13;312(7023):71-2. doi: 10.1136/bmj.312.7023.71.
- Madden K, Bhandari M Can Evidence-Based Medicine and Personalized Medicine Coexist? 2020 Jul 1. In: Rivière C, Vendittoli PA, editors. Personalized Hip and Knee Joint Replacement [Internet]. Cham (CH): Springer; 2020. Chapter 1.
- Lawrence RJ(1), Lee SJ(2), Katona LJ(2)(3), De Bono S(4), Norton PJ(5), Avery S(6). A Self-Help Manual for Psychological Distress and Quality of Life During a Haemopoietic Stem-Cell Transplant: An Effectiveness and Acceptability Pilot . J Clin Psychol Med Settings. 2023 Dec;30(4):846-855. doi: 10.1007/s10880-022-09923-3. Epub 2022 Dec 29.
- Atkins L(1), Steer B(2), Ray H(2), Kiss N(2)(3)(4)(5)Implementing and sustaining an evidence-based nutrition service in a haematology unit for autologous stem cell transplant patients. Support Care Cancer. 2019 Mar;27(3):951-958. doi: 10.1007/s00520-018-4384-x. Epub 2018 Aug 2
- Simoneau TL(1), Kilbourn K(2), Spradley J(3), Laudenslager ML(3).An evidence-based stress management intervention for allogeneic hematopoietic stem cell transplant caregivers: development, feasibility and acceptability.Support Care Cancer. 2017 Aug;25(8):2515-2523. doi: 10.1007/s00520-017-3660-5. Epub 2017 Mar 10.
- Basson T, Montoya A, Neily J, Harmon L, Watts BV. Improving Patient Safety Culture: A Report of a Multifaceted Intervention. J Patient Saf. 2021 Dec 1;17(8):e1097-e1104.
- Peppino Mirabelli 1, Rosa Di Noto, Catia Lo Pardo, Paolo Morabito, Giovanna Abate, Marisa Gorrese, Maddalena Raia, Caterina Pascariello, Giulia Scalia, Marica Gemei, Elisabetta Mariotti, Luigi Del Vecchio. Extended flow cytometry characterization of normal bone marrow progenitor cells by simultaneous detection of aldehyde dehydrogenase and early hematopoietic antigens: implication for erythroid differentiation studies. BMC Physiol 2008 May 29:8:13.
- Mirabelli P, Di Noto R, Lo Pardo C, Morabito P, Abate G, Gorrese M, Raia M, Pascariello C, Scalia G, Gemei M, Mariotti E, Del Vecchio L. European flow cytometry quality assurance guidelines for the diagnosis of primary immune deficiencies and assessment of immune reconstitution following B cell depletion therapies and transplantation. Cytometry B Clin Cytom 2024 Nov;106(6):424-436. doi: 10.1002/cyto.b.22195. Epub 2024 Jun 28.
- Kelleher P, Greathead L, Whitby L, Brando B; UK NEQAS Leucocyte Immunophenotyping Steering Committee; Barnett D, Bloxham D, deTute R, Dunlop A, Farren T, Francis S, Payne D, Scott S, Snowden JA, Sorour Y, Stansfield E, Virgo P, Whitby A.Cytometry B Clin Cytom. 2024 Nov;106(6):424-436. doi: 10.1002/cyto.b.22195. Epub 2024 Jun 28.

Ringraziamenti
Gli autori ringraziano il Prof. Antonio Feliciello per la direzione esatta e capace di integrazione multidisciplinare che ha del laboratorio; sono altresì profondamente grati alla Scrittrice Wanda Marasco per l’occhio attento e affezionato che ha ispirato la consapevolezza del ragionamento, delle prove, del racconto.
Per ulteriori informazioni visitare la pagina AUTORI del Magazine



David_R
4 mesi agoWell-written and concise. Great job.